[바이오타임즈] 한국보건산업진흥원은 2015년부터 해마다 '보건의료R&D 우수성과 사례집'을 발간해왔다. 올해는 지난달 14일에 발간됐으며, 사례집에는 30개의 성공사례와 함께 국내 보건의료R&D의 현황을 정리 제시했다.
바이오타임즈는 이번 취재를 통해 보건의료R&D의 현황을 조망하고 우수성과 사례를 소개하여, 사례집의 편찬목적인 연구정보의 원활한 공유와 활용을 극대화하여 국내 보건의료 R&D 촉진에 보탬이 되고자 시리즈로 게재한다.
본 회에서는 우수성과 사례 중 「급성허혈성 뇌졸중 신약개발」 과제를 소개한다.
사망원인 2위의 뇌졸중, 치료약물은 tPA제제 액티라제가 유일
본 과제 「급성허혈성 뇌졸중 치료제 SP-8203의 개발」은 「첨단의료기술개발사업」의 일환으로 지난 2015년 12월에 시작하여 올해 5월까지 연구가 진행된다. 2018년까지 19.4억원의 연구비가 지원됐다. 연구책임자는 신풍제약의 유제만 대표다.
세계보건기구에 따르면 뇌졸중은 주된 사망 원인 2위로, 전 세계에서 매년 7백만여 명이 사망하고 있는 것으로 알려져 있다. 이러한 현황에도 뇌졸중을 치료하기 위한 약물은 베링거인겔하임의 tPA(tissue Plasminogen Activator: 정맥투여용 혈전용해제) 제제 액티라제(성분명 알테플라제)가 유일하다. 액티라제는 뇌졸중 발병 3~4시간 이내에 투약하지 않으면 약효가 떨어지고 부작용이 발생할 수 있다는 점이 한계가 있다.
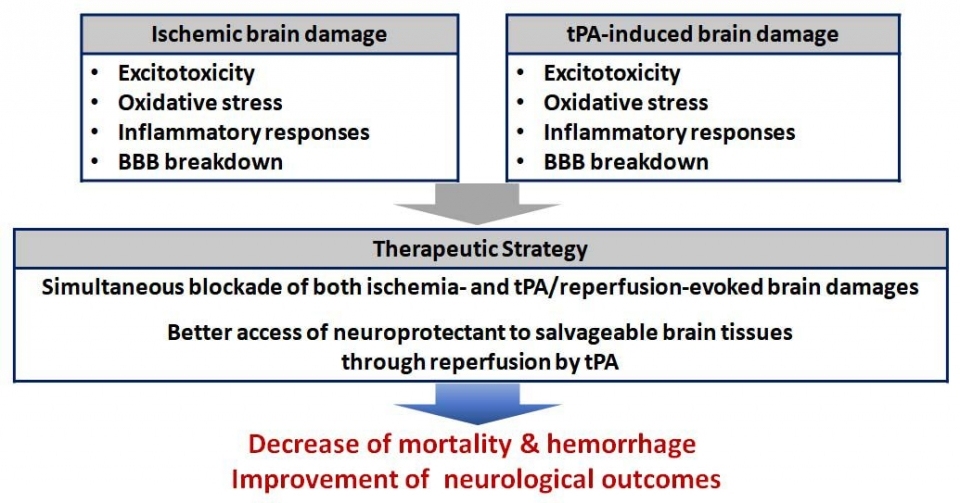
최근에는 기계적 혈전제거술이 미국 심장협회 및 뇌졸중 협회에서 권고되고 있다. 다만 이는 시술이 가능한 큰 동맥에서의 허혈 환자로 국한되고, 출혈 및 재관류에 의한 추가적 뇌손상 위험을 내포하고 있다. 이에 허혈성 뇌손상과 tPA 및 기계적 혈전제거술에 의한 뇌손상을 동시에 차단하는 세포보호제 개발이 필요한 상황이다.
SP-8203, 다중기전 뇌세포 보호작용으로 허혈과 tPA 지연투여에 의한 뇌손상 동시 차단
신풍제약이 개발 중인 SP-8203의 주작용은 허혈 및 tPA 지연투여 후 재관류와 함께 급격히 증가되는 MMP(Matrix Metalloproteinase) 활성을 TIMP(내인성저해제) 발현 증가 기전을 통해 차단하는 것이다.
이와 더불어 항염증작용, 흥분성 신경독성 억제 작용 및 항산화작용을 가지는 다중기전의 뇌세포 보호작용을 통해 허혈과 tPA 지연투여에 의한 뇌손상을 동시에 차단하는 새로운 개념의 First-in-Class의 뇌졸중 치료제다.
다양한 뇌졸중 질환 동물모델에서의 효력결과와 임상1상 결과로 독성학적 안전성을 확보했고, 최근 완료된 임상전기2상 시험 결과에서는 tPA 병용투여 환자에서의 안전성을 확인했다. MRI를 이용한 뇌경색 부피증가 억제를 포함하여 예후에 대해 유의적인 개선 효과를 확인했다.
tPA 치료유효시간 연장으로 대폭적인 시장확대에 기여할 수 있을 것
SP-8203이 tPA의 한계점인 뇌졸중 발병 3~4시간 이내에 투약하지 않으면 약효가 떨어지고 부작용이 늘어나는 점을 개선시킬 수 있다면, 즉 tPA의 치료유효시간을 안전하게 연장시킬 수 있다면 tPA 시장을 10배이상 확대할 수 있을 것으로 기대를 모은다.
물론 환자의 입장에서는 후유증을 최소화하고 예후를 좋게하는 효과를 가지게 된다. 중증도 후유증을 감소시킬 경우에는 이들의 평생치료에 들어가는 천문학적인 사회적 보건비용을 줄일 수 있는 바, 국가적 측면에서도 산업, 경제적 이익을 기대할 수 있다.
2022년 말까지 임상 3상 마치고 2023년 신약승인 신청 계획
신풍제약에 따르면, SP-8203은 현재 전국 14개 대학에서 168명의 뇌졸중 환자를 대상으로 후기2상시험이 진행되고 있으며, 현재까지 80%의 대상자가 모집되어 2020년 상반기 완료를 목표로 하고있다. 이어 2022년 말까지 임상 3상을 마치고 2023년 신약 승인신청(NDA)을 완료할 예정이다.
신풍제약 관계자는 “금번 한국보건산업진흥원의 ‘2019년 보건의료 R&D 우수성과 사례’ 선정은 그동안 불모지와 다름없었던 뇌졸중치료제 개발영역에서 혁신신약개발 가능성을 인정받은 중대한 성과”로 여기며, “현재 활발히 추진 중인 해외 기술이전 노력에도 보탬이 될 것”이라고 밝혔다.
[바이오타임즈=심선식 기자] macsim181@gmail.com


