화학연 황종연 박사팀, ‘유비퀴틴-프로테아좀’ 시스템 활용한 TPD 기술 구축
동아ST에 이어 디엘파마에 기술 이전
치료제 개발이 어려운 다양한 질병에 치료제 만들 수 있는 기반 될 것
[바이오타임즈] 최근 표적 단백질 분해(Targeted Protein Degradation)’ 플랫폼을 활용한 난치성 신약 개발에 탄력이 붙고 있다.
표적 단백질 분해 치료제는 질병의 원인이 되는 단백질을 원천적으로 분해해 치료하는 기술로, 기존 단백질 기능만을 억제하는 기존의 신약 개발 방식보다 효과가 월등하고 내성 문제도 없는 것으로 알려졌다.
즉, 기존 타깃 저해제가 질병을 일으키는 단백질의 기능을 억제하는 반면 단백질 분해 유도제는 질환의 원인이 되는 타깃 단백질을 완전히 제거한다.
국내에서는 지난해 12월 SK㈜가 한국 기업 최초로 미국의 ‘표적 단백질 분해(Targeted Protein Degradation)’ 치료제 시장에 진출한다고 밝혀 관심을 모았다. SK㈜는 미국 혁신 바이오 기업 로이반트(Roivant Sciences)와 전략적 제휴를 맺고, 2억 달러(약 2,200억 원)를 투자해 표적 단백질 분해 플랫폼을 활용한 신약 개발에 나섰다.
◇화학연 황종연 박사팀, ‘유비퀴틴-프로테아좀’ 시스템 활용한 TPD 기술 구축
표적 단백질 분해 신약 개발을 위해서는 수많은 단백질에 대한 방대한 연구가 진행돼야 하므로 빠르고 정확한 연구를 위한 AI 플랫폼은 필수적이다.
글로벌 제약사들은 단백질 분해 플랫폼 기술(TPD)을 확보하기 위한 대규모 투자를 하고 있으나, 아직 국내 연구는 초기 단계에 머무르고 있다.
그러나 한국화학연구원 황종연 박사팀이 ‘유비퀴틴-프로테아좀’ 시스템을 활용한 TPD 기술을 구축, 최근 기업들에 연이어 기술을 이전함으로써 시장을 주도하고 있다.
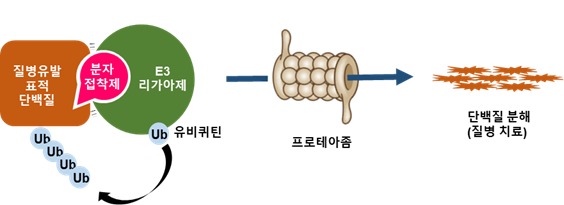
화학연 황종연 박사팀의 설명에 따르면 우리 몸속 세포 내 단백질들은 제 기능을 수행한 후, 수 시간에서 수일 내에 자연적으로 분해된다. 이 단백질 분해 과정 중 하나로 체내의 ‘유비퀴틴-프로테아좀’ 시스템이 있다.
제 역할을 다한 단백질 옆에 ‘유비퀴틴(Ubiquitin)’이라는 물질 여러 개가 표식처럼 붙고, 이 표식을 가진 단백질만 골라서 ‘프로테아좀(Proteasome)’이라는 물질이 해당 단백질을 분쇄기처럼 분해해버린다. 이 과정에서 ‘E3 리가아제’라는 특정 효소가 단백질에 유비퀴틴을 달아주는 역할을 한다. 즉, 질병 단백질과 E3 리가아제 효소가 연결되면 질병 단백질이 자연스럽게 분해될 수 있는 것이다.

◇화학연, 동아ST에는 프로탁 기술 이전...디엘파마에는 분자 접착제 후보물질 이전
TPD 기술에는 분자 접착제 기술과 프로탁 기술이 있다. 분자 접착제(Molecular Glue)는 암 유발 단백질과 우리 몸의 특정 효소(E3 리가아제)를 서로 붙이는 ‘접착제’의 기능을 하는 화합물이다. 암 유발 단백질과 E3 리가아제 효소가 붙으면 암 유발 단백질이 분해되기 때문에 암세포 증식을 막을 수 있다.
분자 접착제는 표적항암제의 문제점인 약물 내성을 극복할 수 있고 적은 투여 용량으로도 치료 효과가 높아 최근 항암제 분야에서 활발히 연구되고 있다.
프로탁 기술(Proteolysis-targeting chimera, PROTAC)은 단백질 분해 기술 중 하나로, 표적 단백질에 결합하는 물질과 E3 리가아제 효소에 결합하는 물질, 그리고 두 물질을 연결해주는 링커(Linker)로 구성된 단백질 분해 기술이다. 프로탁 기술이 적용된 약물은 질병을 유발하는 표적 단백질에 유비퀴틴을 붙여 프로테아좀에 의한 강제적인 분해를 유도한다.
특히, 기존 표적치료제들이 질병을 유발하는 표적 단백질의 특정 부위에 결합해야만 약효를 나타내는 것과는 달리, 프로탁 기술이 적용된 약물은 결합 부위에 상관없이 표적 단백질에 유비퀴틴을 붙일 수 있어 공략 가능한 표적의 한계를 극복할 수 있다.
아울러 결합 부위의 돌연변이로 나타나는 약물 내성의 한계도 극복할 수 있으며, 표적 단백질 분해 후 재사용 될 수 있어 적은 투여 용량으로도 높은 치료 효과를 내고 부작용을 낮출 수 있는 장점도 갖췄다.
화학연 황종연 박사팀은 한국생명과학연구원과 공동으로 개발한 프로탁 기술을 지난 6월 동아ST에 기술을 이전했다. 동아에스티는 이번 계약에 따라 단백질 분해제를 확보하여 차세대 신약 개발 플랫폼 기술을 구축하고 표적항암제 개발을 진행할 계획이다.
또한, 화학연 황종연 박사팀은 새로운 분자 접착제 후보물질을 개발해 14일 ㈜디엘파마(대표이사 최성준)에 기술이전 계약을 체결했다.
이 후보물질은 기존 분자 접착제 후보물질보다 암 성장 억제 효과가 뛰어나며, 경구 투여 시 체내 흡수력이 높아 먹는 약으로 개발될 수 있을 것으로 기대된다.
디엘파마는 최근 신약 개발 분야에서 대규모 투자가 집중되고 있는 표적 단백질 분해제 중 약물성이 개선된 분자 접착제 후보물질을 통해 혈액암 및 고형암을 대상으로 글로벌 경쟁력이 있는 혁신 신약 개발에 박차를 가한다는 계획이다.
단백질 분해 유도제는 그동안 치료제 개발이 어려운 다양한 질병에 치료제를 만들 수 있는 기반이 될 것으로 보인다. 질병 관련 단백질의 85%는 표적 저해제가 강하게 붙을 수 있는 적절한 부위가 없어서 치료제 개발이 어려웠지만, 단백질 분해 유도제의 장점을 이용하면 다양한 난치성 질환 치료제를 만들 가능성이 커지고 있다.
[바이오타임즈=김수진 기자] sjkimcap@biotimes.co.kr


