루게릭병 치료의 새로운 가능성 확인, 고등동물 모델에 적용해 효과적인 치료제 개발할 것

[바이오타임즈] 근위축성측삭경화증, 즉 루게릭병(Amyotrophic Lateral Sclerosis, ALS)은 운동신경 세포만 선택적으로 사멸하는 질환이다.
대뇌 겉질(피질)의 위 운동신경 세포(Upper Motor Neuron, 상위운동신경세포)와 뇌줄기(뇌간) 및 척수의 아래 운동신경 세포(lower motor neuron) 모두가 점차 파괴되는 특징을 보여, 의지에 따라 움직이는 근육인 수의근을 조절하는 신경세포가 소멸해 얼굴, 호흡근 등 전신 근력 저하와 근위축이 진행적으로 일어난다.
루게릭병은 자발적 움직임이 불가능해지다가 결국 숨쉬기에 관여하는 근육인 횡경막의 운동이 멈추면서 사망에 이르게 되지만, 아직 치료제가 없다.
90년대 중반부터 리루텍(Rilutek) 약물을 사용하고 있으나 치료 효과는 미미하다. 통계적으로 2년간 리루텍을 복용하면 생존 기간이 3개월가량 연장되는 것으로 알려져 있다.
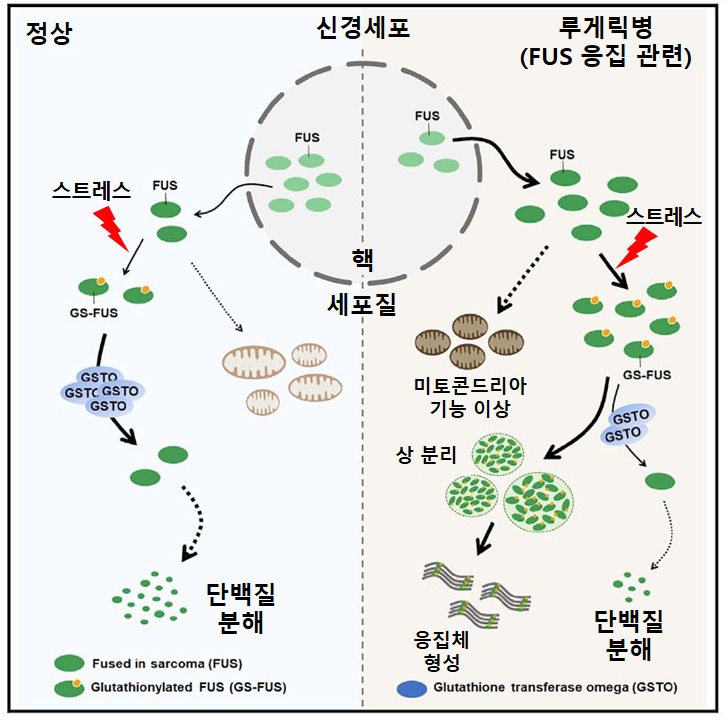
루게릭병의 발병 원인은 환자의 약 10%가 유전적 특징을 보이기도 하지만, 아직 정확하게 규명되지 않았다. 다만 루게릭병 환자 신경세포에서 퍼스(FUS) 단백질, ‘TDP-43’ 등 비정상적 단백질 응집체가 세포질에 과다하게 축적되면 신경세포가 손상되어 퇴행을 일으킨다는 것은 알려져 있다.
그러나 많은 연구에도 불구하고 루게릭병을 유발하는 원인 단백질이 어떻게 응집체를 형성하는지 정확하게 알려지지 않은 가운데, 국내 연구진이 퍼스(FUS) 단백질이 뇌에 손상을 일으키는 과정을 규명함에 따라 퇴행성 신경질환 치료제 개발에 새로운 계기가 마련될 전망이다.
◇순천향대·뇌연구원, 퍼스 단백질 글루타치오닐화 과정 조절로 루게릭병 발병기작 억제 규명
한국기초과학지원연구원(이하 KBSI)은 광주센터 이성수 박사 연구팀이 순천향대학교 의료과학과 김기영 교수 연구팀, 한국뇌연구원 치매연구그룹 김형준 박사 연구팀과의 공동연구를 통해 생체 내 글루타치오닐화(Glutathionylation) 조절을 통한 루게릭병 발병기작 억제법을 개발했다고 28일 밝혔다.
이번 연구 결과는 ‘Therapeutic modulation of GSTO activity rescues FUS-associated neurotoxicity via deglutathionylation in ALS disease models’라는 제목으로 세계적 권위의 학술지 ‘Developmental Cell’(IF=12.270, JCR 상위 3.66%)’에 22일 게재됐으며, 연구성과 관련 국내 특허 등록(2건)과 미국과 일본에서 국제 특허 등록 절차가 진행 중이다.
공동연구팀은 FUS 단백질 응집체를 조절하는 ‘글루타치온 전이효소(GSTO)’를 발굴하고, 이를 초파리 모델 동물에 적용했다. 그 결과, 신경·근육 접합부의 손상이나 행동 퇴행 등 루게릭병 증상들이 억제됨을 확인할 수 있었다.
또한, 초파리 모델 동물과 생쥐 신경세포에서 ‘글루타치온 전이효소(GSTO)’에 의한 FUS 단백질 응집체의 글루타치오닐화 조절을 통해 루게릭병에서 보이는 FUS 단백질 응집체의 과다한 축적을 억제하여 신경세포의 손상을 막을 수 있다는 사실을 세계 최초로 증명했다.
글루타치온은 대표적인 체내 항산화물질로, 활성산소에 의해 발생하는 각종 산화적 스트레스로부터 세포의 손상을 막고 세포를 보호할 수 있다.

◇루게릭병 치료의 새로운 가능성 확인, 고등동물 모델에 적용해 효과적인 치료제 개발할 것
이번 연구는 향후 루게릭병 환자의 신경세포 내 축적된 비정상 단백질 형성을 조절할 수 있는 치료제 개발과 이를 검출하는 진단기기 개발에 새로운 시금석이 될 것으로 평가된다.
이번 공동연구 결과는 발생학 분야 최상위 학술지인 ‘Developmental Cell誌’ 온라인판[논문명 : Therapeutic modulation of GSTO activity rescues FUS- associated neurotoxicity via deglutathionylation in ALS disease models, IF=12.270, JCR 상위 3.66%, 순천향대 차선주(공동제1저자), KBSI 이성수(공동제1저자), 한국뇌연구원 김형준(공동교신저자), 순천향대 김기영(공동교신저자)]에 22일(화) 게재됐다.
KBSI는 광주센터가 보유한 고령 동물 생육시설과 3차원 홀로토모그래피(3D Holotomography), 발광-형광 전임상 분자 영상 시스템(IVIS Spectrum) 등 첨단 광학 영상 분석 장비를 활용해 초파리·마우스 등 질환 모델 동물을 대상으로 퇴행성 신경질환에 대한 신규 발병기전을 규명하는 후속 연구를 이어나갈 계획이다.
순천향대 김기영 교수와 한국뇌연구원 김형준 박사는 “이번 연구는 최초로 ‘글루타치오닐화’라는 새로운 단백질의 변형과정이 어떻게 루게릭병 발병과정에 관여하는지 정확한 기전을 규명해 루게릭병 치료의 새로운 가능성을 확인한 것에 의의가 있다”며 “후속 연구를 통해 루게릭병의 원인 규명에 한 발 더 다가설 수 있을 것으로 생각되며, 고등동물 모델에 적용하여 효과적인 치료제 개발연구를 추진할 계획이다”라고 말했다.
KBSI 이성수 박사는 “이번 연구성과는 루게릭병 발병기전에 대한 이해를 높이고 신규 치료제 개발을 위한 새로운 전략을 세우는 데 도움을 줄 것”이라며 “KBSI 광주센터의 고령 동물 생육시설과 첨단 분석 장비를 이용하여 실시간 생체 분석 기술 기반 퇴행성 신경질환 연구 등 국가 차원의 분석과학 원천기술 개발연구에 매진할 계획”이라고 밝혔다.
이번 연구는 KBSI 광주센터 운영사업, 단백질 응집 유래 난치성 노화 질병 극복을 위한 통합분석시스템 구축사업, 순천향대학교 BK21FOUR사업, 한국연구재단 신진연구자지원사업, 중견연구자지원사업, 한국뇌연구원의 지원을 통해 수행되었다.
한편 2019년도에 발표된 연구에 따르면 2011년부터 2015년 사이에 국내 ALS 신규환자 수는 3,049명이었으며, 평균 50개월의 추정 생존 기간을 보였다. 루게릭병은 진단을 빨리 받을수록 병의 예후가 좋아서 조기진단 후 적절한 치료가 이뤄진다면 국내 환자의 예후 향상에 긍정적일 것으로 평가된다.
[바이오타임즈=정민구 기자] news@biotimes.co.kr


