마드리갈 파마슈티컬스, 오는 3월 MASH 신약 허가 기대
한미약품, 동아에스티, 유한양행, HK이노엔, 일동제약 등 글로벌 임상 순항
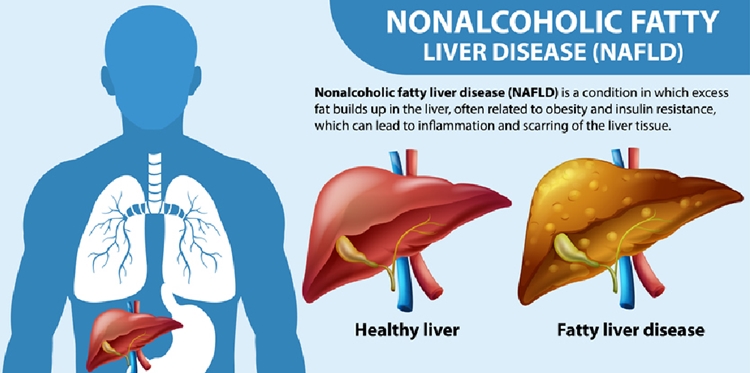
[바이오타임즈] 대사이상 관련 지방간염(MASH) 치료제에 대한 미국 식품의약국(FDA) 첫 허가가 예고되면서 시장의 기대감이 커지고 있다. 미충족 의료 수요를 해소할 ‘첫 신약 탄생’ 이슈에 국내 MASH 개발 기업의 신약 개발에도 더욱 속도가 붙을 것으로 전망된다.
◇ 비알코올성 지방간염 시장 확대 전망… 2026년 33조 원으로 커진다
MASH는 알코올 섭취 없이도 간에서 염증이나 섬유화 등이 발생하는 질환으로, 포도당 대사에 중요한 역할을 당하는 인슐린 기능이 저하되면서 간에 과도한 지방이 축적돼 발생한다.
비만과 당뇨병과 같이 대사 과정의 이상으로 발병하는 지방간염으로, 염증을 동반하지 않는 단순 지방간부터 만성 간염과 간경변증에 이르는 다양한 형태의 간질환을 포함한다.
기존에는 NASH(비알코올성지방간염)라는 명칭을 사용했으나 미국 간질환 연구협회 등 해외 학회에서 명칭 변경을 결의하며 MASH로 불린다.
현재 전 세계 MASH 환자 수는 4억 4,000만 명 이상으로 추산된다. 건강보험심사평가원 집계 결과에 따르면 국내 환자 수는 따르면 2021년 기준 우리나라 MASH 환자 수는 약 40만 6,000명이다.
시장조사기관 글로벌데이터에 따르면 글로벌 MASH 치료제 시장은 2026년 253억 달러(약 33조 8,000억 원) 규모에 이를 것으로 전망된다. MASH 관련 수요가 증가하고 있음에도 불구하고 현재까지 미국 FDA 승인을 받은 치료제가 없는 상황이다.
이런 상황에 올해 1분기 미충족 의료 수요를 해소할 '글로벌 1호 MASH 치료제'가 탄생할 것으로 기대돼 업계의 이목이 쏠리고 있다.
◇ 마드리갈 파마슈티컬스, 오는 3월 MASH 신약 허가 기대감↑
업계에 따르면 미국 바이오벤처 마드리갈 파마슈티컬스가 개발한 MASH 치료제 ‘레스메티롬(Resmetirom)’에 대한 미국 FDA의 승인 여부가 오는 3월경 최종 결정된다.
마드리갈 파마슈티컬스는 955명이 참여한 대규모 임상 3상인 'MAESTRO-NASH Trial'를 완료하고 위약(가짜 약) 대비 통계적 우월성을 입증했다. 1차 평가변수 중 하나였던 52주 차에 MASH 해소에 도달했으며, 비알코올성 지방간 활성 점수(NAS)가 2점 이상 감소한 환자 비율이 레스메티롬 80㎎ 투여군에서 26%, 100㎎ 투여군에서 30%로 확인됐다.
레스메티롬은 갑상선호르몬 수용체(THR)-β에 선택적으로 작용하는 약물로, 간 내부에서 비알코올성 지방간염의 핵심 기저 원인들을 표적으로 작용하도록 설계됐다.
시판 허가를 받으면 세계 첫 MASH 치료제로서 10억 달러(약 1조 4,000억 원) 매출을 올리는 글로벌 블록버스터 등극과 동시에 단숨에 시장 선점이 예상된다. 아울러 경쟁 약물의 개발을 촉진하는 동력으로 작용해 관련 시장이 더욱 가파른 성장세를 보일 것으로 관측된다.
MASH 치료제는 전 세계적으로 57개 기업이 70여 개의 파이프라인을 발굴해 개발에 나서고 있다고 알려졌다.
일라이릴리와 노보노디스크 등 빅파마가 MASH 치료제 임상시험 중에 있으며, 네덜란드 노스씨테라퓨틱스, 미국 턴스파마슈티컬스, 미국 아케로테라퓨틱스, 미국 바이킹테라퓨틱스 등 바이오텍도 지난해 11월 열린 미국간학회(AASLD) 연례학술대회에서 MASH 후보물질의 긍정적인 데이터를 발표해 눈길을 끌었다.

◇ K-바이오도 미충족 수요 MASH 치료제 개발 집중... 개발 현황은?
전 세계적으로 MASH 치료제 개발 노력이 이어지는 가운데, 국내 개발 기업의 임상시험도 유의미한 결과를 얻고 있어 주목된다.
국내 기업 중에선 한미약품이 MASH 신약 임상에서 가장 앞서고 있다. 한미약품은 ‘에피노페그듀타이드(MK-6024)’, ‘에포시페그트루타이드(Efocipegtrutide·LAPSTriple agonist)’ 등 MASH 관련 파이프라인 2개를 확보하고 있으며, 모두 글로벌 임상 2상을 진행 중이다.
에피노페그듀타이드는 지난 2020년 미국 머크사에 기술 수출됐으며, 지난해 6월 미국 FDA로부터 신속 허가심사 대상(패스트트랙)을 지정받았다. 현재 임상 2b상 진입을 앞두고 있다.
에포시페그트루타이드는 GLP-1(글루카곤유사펩타이드-1) 수용체·글루카곤 수용체·GIP 수용체 3가지를 모두 활성화하는 삼중 작용 바이오신약이다. 지난해 11월 AASLD에서 간 염증 및 섬유화 개선 효과를 확인시켰고, 오는 6월 미국 당뇨학회를 통해 전임상 효능을 입증할 예정이다.
한미약품은 다중 약리학적 효과를 토대로 MASH 환자의 지방간·간 염증·간 섬유화 등 복합 증상을 효과적으로 개선할 수 있을 것으로 기대한다.
동아에스티의 경우 자회사인 뉴로보 파마슈티컬스가 이달 MASH 치료제 ‘DA-1241’의 글로벌 임상 2상 파트2를 개시했다. 뉴로보는 이번 임상 2상 파트 2에서 DA-1241과 시타글립틴 병용투여의 효능과 안정성을 확인할 예정이다.
뉴로보에 따르면 DA-1241과 시타글립틴 병용투여 전임상에서 독성 없음과 안전성이 입증됐고, DA-1241 단독 투여와 비교해 항염증 효과도 증가한 것으로 확인됐다. 뉴로보는 지난해 5월 DA-1241-의 단독 효능과 안정성을 확인하기 위해 임상 2상 파트 1을 진행했으며, 올해 하반기에 임상 2상 파트 1과 파트 2를 종료할 계획이다.
유한양행은 2019년 글로벌 제약사 베링거인겔하임에 ‘YH25724’를 기술 수출하고 공동개발을 진행 중이다. YH25724는 국내 바이오기업 제넥신의 항체 융합 단백질 플랫폼 기술 ‘하이브리드 FC(HyFc)’를 접목한 융합단백질로 GLP1‧FGF21 이중 작용제다.
회사 측에 따르면 전임상연구 결과, YH25724는 지방간염 해소와 직접적 항섬유화 효과를 발생해 간세포 손상과 간 염증을 감소시키는 것으로 나타났으며 2021년 11월 유럽에서 임상 1상을 시작해 현재 진행 중이다.
HK이노엔은 신약 개발사 퓨처메디신으로부터 MASH 신약후보 물질 ‘FM101’을 도입해 공동개발하고 있다. FM101은 간의 섬유화와 염증을 억제하는 기전을 갖는 물질이다.
일동제약의 MASH 신약후보 물질 'ID119031166'은 Farnesoid X(FXR) 수용체 작용제다. FXR 작용제는 MASH에서 지질 및 담즙 대사 기능 장애의 주요 원인이 되는 FXR 발현 장애를 교정한다. ID119031166은 간 섬유화 개선 및 간독성 부작용 회피 등에 효과가 있는 물질로, 현재 글로벌 1상이 진행 중이다.
업계 관계자는 “"MASH는 전 세계 4억 명 이상의 환자가 존재해 약물 수요가 크지만, 아직 치료제가 없어 대표적인 블루오션 분야 중 하나”라고 설명하며, “마드리갈 파마슈티컬스가 개발한 MASH 치료제 레스메티롬이 FDA의 허가를 획득하게 되면 후속 개발 파이프라인에 대한 관심도 높아질 것”으로 전망했다. 이어 “최초 신약 등장을 앞두고 국내 시장도 폭발적인 성장이 예상되는 가운데, 국내 기업의 유의미한 임상 결과도 주목할 만하다”고 말했다.
[바이오타임즈=김가람 기자] news@biotimes.co.kr


