말단비대증, 신경뇌분비 종양의 제어 및 뇌 기능을 향상할 수 있는 물질 개발에 이용 가능

[바이오타임즈] 성장 억제 호르몬으로 알려진 ‘소마토스타틴’은 아미노산으로 이루어진 펩타이드 호르몬으로, 신경전달 물질 및 호르몬의 분비를 조절하고 뇌 신경 물질 전달에 작용한다.
소마토스타틴은 소마토스타틴 수용체와 결합하여, 세포 내 아데닐릴 사이클레이즈(Adenylyl Cyclase)의 활성을 억제한다. 소마토스타틴은 거대비대증, 암 및 뇌 질환 등 다양한 질병에 관여하며, 소마토스타틴을 모방한 옥트레오타이드(Octreotide), 란레오타이드(Lanreotide) 등의 약이 현재 사용 중이다.
또한, 소마토스타틴 수용체의 이성질형인 SSTR2는 뇌와 호르몬 분비 세포에 존재하여, 신경뇌 분비 종양 및 알츠하이머 병 유발에 중요한 역할을 한다.
그간 소마토스타틴이 그 수용체에 결합하는 기작이 밝혀지지 않아 호르몬 분비 제어 물질의 개발이 불가능했다.
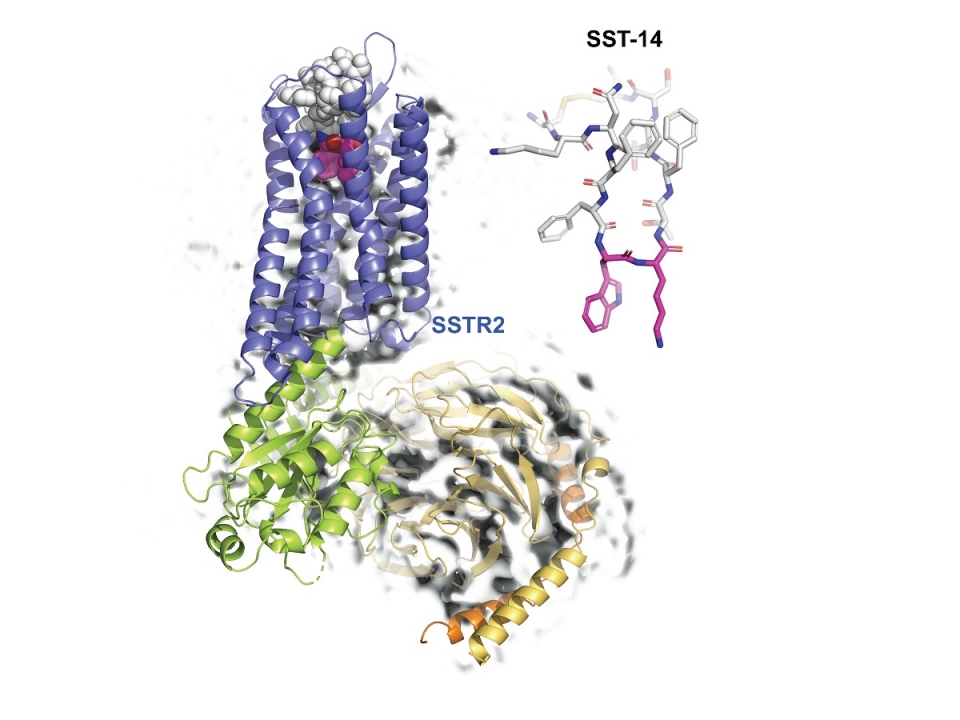
◇카이스트 송지준 교수 연구팀, 소마토스타틴과 수용체 간 3차원 원자 해상도 구조 규명
KAIST 생명과학과 송지준 교수 연구팀은 초저온 전자 현미경(cryo-Electron Microscopy)을 이용해 호르몬 조절 물질인 소마토스타틴(somatostatin)과 그 수용체인 소마토스타틴 리셉터 2(Somatostatin Receptor 2, 이하 SSTR2) 복합체의 3차원 원자 해상도 구조를 규명해 호르몬 조절 메커니즘을 밝혔다고 6일 밝혔다.
송 교수 연구팀은 연세대학교 이원태 교수 연구팀, 피씨지-바이오텍 연구팀과의 공동연구를 통해, 소마토스타틴과 결합해 다양한 호르몬의 분비를 억제하는 SSTR2 복합체 구조를 3차원 원자 해상도로 초저온 전자 현미경을 이용해 규명하고, 소마토스타틴이 SSTR2를 통해 호르몬 분비를 억제하는 메커니즘을 규명했다. 이러한 연구 결과는 호르몬 분비의 이상에서 유발되는 말단비대증, 신경 뇌분비 종양을 제어하는 방법을 개발하는데 적용될 수 있을 것으로 기대된다.
KAIST 생명과학과 윤어진 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 ‘이라이프(eLife)’에 4월 22일에 출판됐다.(논문명 : Cryo-EM structure of the human somatostatin receptor 2 complex with its agonist somatostatin delineates the ligand binding specificity)
SSTR2은 세포막에 존재하는 막 단백질로, 세포 밖의 소마토스타틴을 신호로 인식해 세포 내로 전달하는 역할을 한다. 최근 KAIST 생명과학과 이승희 교수 연구팀에서도 소마토스타틴이 인지기능 향상에 기여한다 것을 밝힌 바 있다.
이렇게 소마토스타틴의 생체 내 기능 및 질병에 역할의 중요성에도 불구하고, 소마토스타틴이 세포막에 존재하는 수용체와 결합하는 자세한 메커니즘에 대해서는 알려지지 않았고, 신약 개발에 필수적인 역할을 하는 3차원 원자구조도 알려지지 않았다.

◇말단비대증, 신경 뇌분비 종양의 제어 및 뇌 기능을 향상할 수 있는 물질 개발에 이용 가능
송지준 교수 연구팀은 소마토스타틴이 수용체인 SSTR2와 결합하는 원리를 규명하기 위해, 초저온 전자 현미경을 이용해 소마토스타틴이 결합된 SSTR2 복합체의 원자 3차원 구조를 규명했다. 또한 연구팀은 소마토스타틴과 수용체가 결합한 3차원 구조를 바탕으로 소마토스타틴과 결합하는데 중요한 아미노산들을 발견하고, 이들의 기능성을 세포 내에서 확인했다.
구조 규명 결과 SSTR2의 세포 밖에 위치하는 부분에 SST-14가 결합할 수 있는 포켓을 형성하는 것을 보였고, SST-14의 트립토판-라이신이 포켓의 바닥에 위치하여 결합하는 것으로 밝혀졌다. 따라서 이러한 결합이 SSTR2의 기능에 중요한지를 확인하기 위하여 인간 세포를 이용하여 그 기능성을 확인했다.
소마토스타틴 수용체의 이성질형이 다수 존재하는데, 이들의 기능 및 소마토스타틴 결합 기작에 대해서는 알려지지 않았다. 연구팀은 인공지능을 이용한 구조예측 프로그램인 알파폴드(AlphaFold)를 이용해 소마토스타틴 수용체의 이성질 형태(같은 분자식을 갖는 화합물이지만 분자 구조가 다른 형태)인 SSTR1, SSTR3, SSTR4, SSTR5의 구조를 예측해 이성질 형태 각각의 소마토스타틴 결합 메커니즘을 밝혀냈다.
이번 연구 결과는 소마토스타틴 수용체의 작용 메커니즘을 이용해 호르몬 분비의 이상에서 유발되는 말단비대증, 신경뇌분비 종양의 제어 및 뇌 기능을 향상할 수 있는 물질 개발에 이용될 수 있을 것으로 기대된다.
[바이오타임즈=정민아 기자] news@biotimes.co.kr


