PemK와 PemI의 결합을 방해하는 물질을 설계할 수 있는 삼차원 구조정보 규명
두 단백질의 강제적인 결합 방해하면 세포 자살 유도 가능
구조 기반 약물 설계법으로 병원성균의 독소-항독소 단백질을 표적하는 약물 개발할 것

[바이오타임즈] 강력한 항생제에도 죽지 않는 슈퍼박테리아를 퇴치할 수 있는 원리를 국내 연구진이 밝혀내서 화제다.
한국연구재단 이봉진 교수(서울대학교), 이상재 박사(포항가속기연구소), 김도희 교수(제주대학교), 강성민 교수(덕성여자대학교) 공동 연구팀은 패혈증을 일으키는 포도상구균 외 폐렴막대균, 탄저균, 결핵균의 자살 유도 작용을 밝혀 새로운 항생제 개발에 대한 단서를 제공했다.
2019년 한 해 항생제 내성균 감염이 직접적 사인이 된 경우가 127만 건이며, 이로 인해 간접적으로 건강이 악화해 사망한 사례는 495만 건에 달했다. 질병관리청은 지금 같은 추세로 항생제 내성 때문에 사망자가 발생하면 2050년경에는 한 해에만 1,000만 명의 사망자가 발생할 것으로 경고하고 있다.
이 같은 상황에도 불구하고 최근 포도상구균, 결핵균 등의 내성 문제를 극복할 수 있는 항생제 개발은 전 세계적으로 정체된 실정이다. 2020년 세계보건기구(WHO) 보고에 따르면 대부분의 신규 항생제들은 슈퍼박테리아에 취약하며, 새로 개발된 항생제들은 그람 음성 병원균을 주 대상으로 개발되었다.
특히, 현재 전 세계가 코로나 팬데믹의 영향으로, 코로나 변이에 대응하기 위한 의약품 개발에 집중하고 있다. 이에 사망률이 매우 높은 패혈증 등을 일으키는 그람 양성균인 메티실린 내성 포도상구균(MRSA)이나 세균학상 그람 음성균이 아닌 다제내성 결핵균 (MDR TB)에 대한 신규 항생제 개발이 시급한 실정이다.
◇이봉진 서울대 교수 등 공동연구팀, 정밀 신개념 항생제 개발을 위한 토대 제시
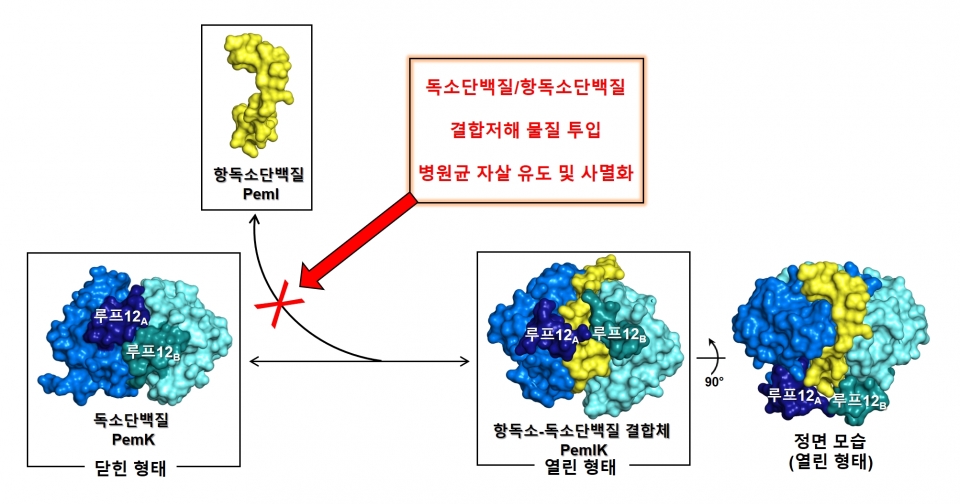
한국연구재단 공동연구진은 병원성균 유래의 독소-항독소 단백질이 인간에게는 없다는 사실과, 병원균의 내성 문제를 우회하기 위해 병원균에 내재한 독소 단백질의 제어를 방해하면 세포자살을 유도할 수 있다는 사실에서 해결의 실마리를 찾았다.
따라서 연구팀은 포도상구균 유래 제2유형의 독소-항독소 단백질인 PemK-PemI의 연구를 진행하게 됐다. 지금까지 독소-항독소의 작용기전 규명에 있어서 PemK-PemI의 복합체 구조 규명은 필수적이었지만 결정화가 쉽지 않았고, 독소 단백질의 단독 구조만으로는 독소-항독소 시스템의 작용기전을 예측하기는 어려웠다. 연구팀은 다양한 시도를 해오던 중 단백질 엔지니어링기법을 활용하여 독소 단백질에 결합하는 부분 위주로 된 항독소 절편을 만들어 결합한 후 복합체 구조를 규명할 수 있었다.
그 결과, 새로운 독소-항독소 단백질의 삼차원 구조를 규명 및 해석하여 독소 활성화를 통한 병원균 사멸 유도 원리를 확인했으며, 이를 통해 기존의 항생제와는 완전히 다른 신규 항생제 개발을 할 수 있을 것으로 예측했다.

◇독소 단백질-항독소 단백질의 강제적인 결합 방해하면 세포 자살 유도 가능
연구팀은 그람 양성균인 포도상구균 유래의 독소 단백질인 PemK와 독소-항독소 결합체 단백질인 PemIK의 삼차원 구조를 X선-결정학법을 이용하여 해석에 성공했다. 그람 양성균은 그람 염색법에 의해 세포벽이 보라색으로 염색되는 세균을 총칭하는 것으로, 결핵균, 디프테리아균, 방선균, 파상풍균, 폐렴균, 포도상구균 등이 해당한다. 연구팀은 이 과정에서 항독소 단백질 PemI가 독소 단백질 PemK의 일부 구조를 모방하는 독특한 작용을 이용하여 상호 결합함을 관찰할 수 있었다.
또한, 생물리학 분석을 시행하여 독소 단백질의 활성화 부위를 확인, 활성 유지를 통해 병원균의 mRNA(단백질을 합성하는 유전정보가 담긴 핵산류)를 분해하는 것을 밝혔다.
이를 통해 두 단백질의 강제적인 결합 방해를 통해 독소 단백질 PemK가 지속적인 독소 활성능을 나타내게 함으로써 포도상구균, 폐렴막대균, 탄저균, 결핵균을 사멸시킬 수 있다고 밝혔다.
본 연구 결과를 통해 두 단백질 PemK와 PemI의 결합을 방해하는 물질을 설계할 수 있는 삼차원 구조정보를 밝혔으며, 병원균들이 스스로 자멸하게 유도할 수 있는 신개념 항생제 설계의 토대를 제시했다.
이봉진 교수는 이번 연구성과에 대해 “병원성균 유래 독소-항독소 단백질은 병원균의 독성 및 생존에 중요한 역할을 함으로써 여러 방면으로 연구가 되어 왔지만, 현재까지 구조적인 관점에서의 연구는 독소 단백질 단독 연구이거나 독소-항독소 복합체 구조 단독 연구에 그쳐 두 구조 간의 비교연구는 어려운 실정이었다”라며 “이번 연구에서 독소 단백질 단독 구조와 독소 단백질의 효소 활성화 부위에 결합한 항독소 단백질의 구조를 동시에 규명한 것이 이번 연구의 일차적인 성과이며, 나아가 독소 단백질의 효소 활성화 부위 규명 및 항독소 단백질이 독소 단백질 구조의 일부 형태를 동일하게 만드는 전략(loop mimic)으로 결합하는 등 생명체의 생존 전략을 새로 밝혀낸 것이 기존 연구와는 차별화되는 중요 성과”라고 설명했다.
이어 이 교수는 “본 연구팀의 결과물을 활용하여 구조 기반 약물 설계법을 이용한 빠른 약물 개발을 가능하게 할 수 있다. 따라서, 슈퍼박테리아 중 빠른 대처가 필요한 메티실린 내성 황색포도상구균뿐만 아니라 폐렴막대균, 탄저균, 결핵균에 대처할 수 있는 약물 설계의 실마리가 될 것”이라고 밝혔다.
연구팀은 전 세계에서 5개국만 보유하고 있는 포항 4세대 방사광가속기를 활용하여 실온 상태의 약물 결합 단백질 연구와 항생제 개발을 병행할 계획이다.
아울러 이번 연구 결과를 바탕으로 신규 항생제 개발의 실용화를 위해서 구조 기반 약물 설계법(structure-based drug discovery)을 활용하여 병원성균의 독소-항독소 단백질을 표적으로 하는 약물 후보물질을 도출 및 규명하는 연구를 후속 연구로 진행할 계획이다.
[바이오타임즈=정민아 기자] news@biotimes.co.kr


