PHI-501, NRAS의 신호 경로를 표적화한 최초의 항암치료제
[바이오타임즈] ㈜파로스아이바이오(대표 윤정혁)는 차세대 급성골수성백혈병 NRAS 돌연변이 표적항암제 ‘PHI-501’이 미국 식품의약국(FDA)로부터 희귀의약품 지정을 받았다고 10일 밝혔다.
이번 승인으로 회사는 지난 2019년 주력 파이프라인인 ‘PHI-101 AML(차세대 급성골수성백혈병 FLT3 저해제)’이 FDA로부터 희귀의약품 지정 승인을 받은 데 이어 두 번째 성과를 거두게 됐다.
파로스아이바이오는 자체 개발한 빅데이터 및 AI 기술 기반의 신약개발 플랫폼 ‘케미버스 (Chemiverse)’와 오픈 이노베이션 전략을 통해 희귀난치성 질환 치료제를 중점적으로 개발하는 신약개발 전문 기업이다. 회사는 케미버스를 활용해 발굴한 신약후보물질(PHI-101)을 국내 최초로 임상 1상 단계까지 발전시키며 신약 개발 플랫폼 기술을 통한 희귀난치성 질환 전문 신약개발 역량을 강화하고 있다.
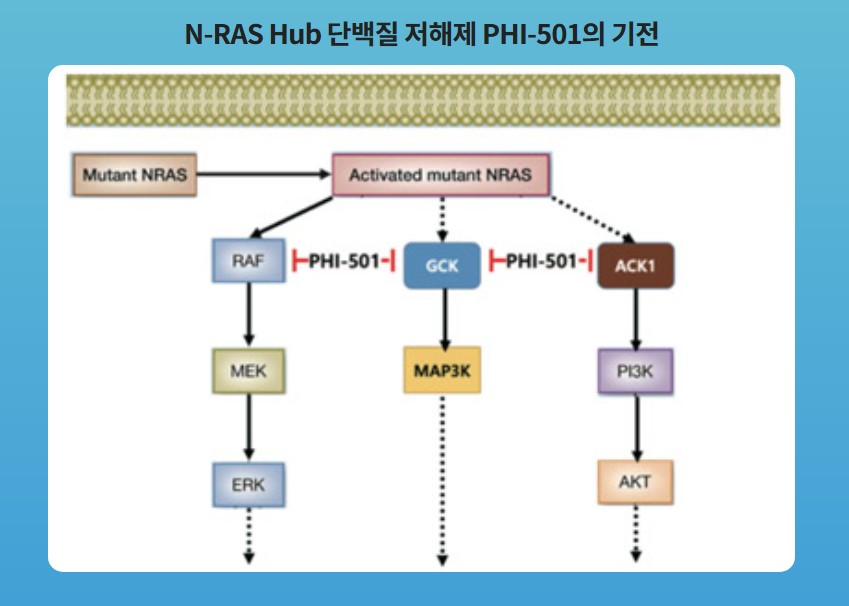
파로스아이바이오가 개발 중인 ‘PHI-501’은 NRAS의 신호 경로를 표적화한 치료제로, 합성치사(Synthetic lethality)를 통해 더욱 효과적인 활성 억제 방법을 사용한 최초의 NRAS 변이 항암치료제다. NRAS는 급성골수성 백혈병에서 세포의 분화, 증식, 생존 등에 굉장히 중요한 역할을 하는 단백질이며, NRAS 돌연변이에 의하여 세포 성장 신호가 지속해서 전달돼, 세포가 계속 자라게 되면서 암이 성장하게 된다.
‘Decision Resources Group’에 따르면 급성골수성백혈병은 65세 이상의 고령층에서 급격하게 발생이 증가하는 희귀난치성 질환으로서 특히 미국 및 유럽 등에서 많이 발생하고 있다. 치료제의 세계 시장 규모는 2025년 25억 달러(한화 약 2조 7,500억 원)로 연평균 15% 정도 성장할 것으로 전망되고 있다.
현재 파로스아이바이오는 다국적 임상 진행 중인 급성골수성백혈병 FLT3 표적항암제 ‘PHI-101 AML’을 포함한 8개 신약 파이프라인과 독자 개발 및 구축한 빅데이터 및 AI 기반 신약 개발 플랫폼 기술을 확보하고 있다. 이를 기반으로 다국적 제약사와 신약 개발기업 및 해외 유수 기관들과의 오픈이노베이션 전략을 통한 공동 연구개발 및 기술 이전 등 다수의 사업화 프로젝트 추진을 검토 중이다.
글로벌 제약사 로슈의 수석연구원 출신으로 2020년 파로스아이바이오에 합류한 한혜정 CDO(신약 총괄개발 사장)는 "이번 FDA 희귀질환 치료제 지정 승인으로 추후 FDA의 임상 승인 및 허가 심사 기간 단축, 전문의약품 허가 신청비와 세금 감면 및 7년간 독점권 인정 등 다양한 혜택을 받을 수 있을 것으로 기대된다”라면서 “또한 PHI-501의 가치를 인정받고 글로벌 시장 진출을 위한 글로벌 임상 개발을 보다 가속화 할 수 있을 것”이라고 밝혔다.
한편 회사는 최근 안양 본사에 합성 및 바이오 연구실을 자체 설립해 인공지능 신약개발 플랫폼인 케미버스를 통한 신약후보물질의 설계 및 발굴과 더불어 합성물질의 구현까지 자체적으로 연구 개발할 수 있는 인프라를 구축했다. IT 및 임상 관련 우수 연구인력 유치를 위해 서울사무소도 개소하여 바이오인공지능연구소를 확장 운영하고 있다. 또한 상장 주관사인 한국투자증권과 함께 2022년 코스닥 상장을 위한 준비를 진행 중이다.
[바이오타임즈=박세아 기자] news@biotimes.co.kr


