인도 Biocon Biologics, 마일란의 바이오시밀러 사업을 33억 달러에 인수
연이은 인터체인저블 바이오시밀러 지정으로 미국 바이오시밀러 시장의 확대 가속
우리 기업들도 차별된 전략으로 시장 경쟁에 대비해야 할 것

[바이오타임즈] 신약보다 가치를 인정받지 못했던 바이오시밀러가 바이오의약품 시장의 핵심으로 떠오르고 있다.
관련 시장 규모도 2017년 97억 달러에서 2023년 481억 달러 규모로 연평균 26.4%의 성장률을 보일 것으로 예측된다.
‘바이오시밀러’(Biosimilar)는 바이오의약품에서 복제된 약이다. 처음 개발한 의약품을 ‘오리지널’(Original), 특허가 만료된 의약품을 구조적으로 같게 만든 의약품을 ‘복제약’(Generic Drug)이라고 한다.
바이오의약품은 사람이나 다른 생물체에서 유래된 단백질 등을 원료 또는 재료로 활용해 제조한 것이다. 제조회사에 따라 세포의 생산조건과 단백질 의약품의 정제방법이 달라서 오리지널 바이오의약품과 완벽하게 같지 않기 때문에 ‘바이오시밀러’라고 부른다.
바이오시밀러는 이미 검증된 제품을 생산하기 때문에 단기간에 목표 시장의 진입도 가능해 새로운 성장동력으로 주목받고 있다. 특히 스텔라라, 프롤리아(성분명 데노수맙), 루센티스(성분명 라니비주맙), 아바스틴(성분명 베바시주맙) 등 특허 만료를 앞둔 블록버스터 의약품들이 많아 시장의 성장 잠재력을 높게 평가받고 있다.

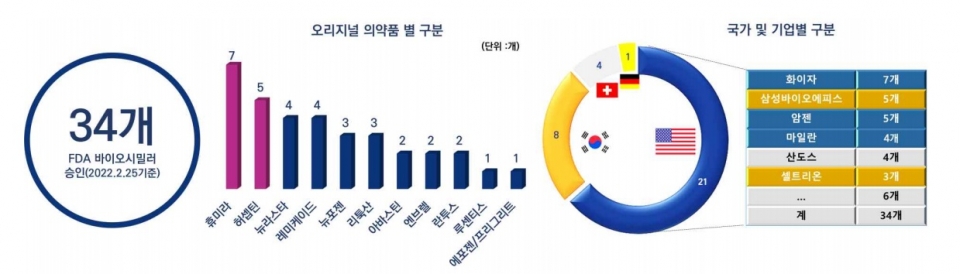
◇2월 25일 기준, 총 34개의 바이오시밀러가 미국 FDA 허가 획득
한국바이오협회의 자료에 따르면 세계 최대 의약품 시장인 미국에서 2022년 2월 25일 현재 총 34개의 바이오시밀러가 FDA 허가를 받았다. 2022년 들어서는 처음으로 지난 25일 미국 Amneal Pharmaceuticals와 Kashiv Biosciences가 공동으로 개발한 뉴포젠 바이오시밀러인 릴류코(Releuk)가 34번째로 허가를 받았다.
또한, 허가받은 34개의 바이오시밀러 중 미국 마일란의 샘글리(Semglee)와 독일 베링거인겔하임의 실테조(Cyltezo)는 처음으로 상호 교체 가능한 바이오시밀러(Interchangeable Biosimilar)로 지정받았다.
인터체인저블 바이오시밀러란 오리지널 의약품과 서로 교체 처방(Interchangeable)이 가능한 의약품을 말한다. 미국 FDA는 바이오시밀러 개발업체가 어떤 환자에게 처방하더라도 바이오시밀러나 오리지널 의약품이 같은 임상적 결과를 만들어낼 수 있다는 것을 증명할 수 있다면 그 바이오시밀러를 인터체인저블한 바이오시밀러로 지정할 수 있다고 규정한다. 미국에서 ‘인터체인저블 바이오시밀러’로 지정받으면 의사의 처방 없이 약국에서 대체 처방이 가능하다.
미국 FDA로부터 첫 번째 인터체인저블 바이오시밀러로 허가받은 마일란(Mylan)의 당뇨병 치료제 셈글리(Semglee)는 오리지널 의약품인 프랑스 사노피의 란투스(Lantus)의 바이오시밀러 제품이다. 셈글리는 바이알 및 프리필드 펜 제형으로, 성인 2형 당뇨병 환자들과 소아 및 성인 1형 당뇨병 환자들에게서 높은 혈당 수치를 낮추는 용도의 약물로 발매를 승인받았다. 대조 의약품인 ‘란투스’와 아미노산 배열이 같고, 허가를 취득한 적응증도 같은 항당뇨제이다.
셈글리에 이은 두 번째 인터체인저블 바이오시밀러로 허가받은 실테조(Cyltezo)는 글로벌 블록버스터 ‘휴미라’의 바이오시밀러다. 휴미라는 류머티즘성 관절염 등의 자가면역질환 치료에 사용되는 치료제로, 전 세계 판매 1위의 의약품이다.
기존에 휴미라의 바이오시밀러로 FDA 허가를 받은 암젠의 Amjevita는 2023년 1월, 삼성바이오에피스의 Hadlima는 2023년 6월, Viatria(마일란)와 Fujifilm Kyowa Kirin의 Hulio는 2023년 7월, 산도즈의 Hyrimoz는 2023년 9월, 화이자의 Abrilada는 2023년 11월에 각각 출시 예정이다.
◇인도 Biocon Biologics, 마일란의 바이오시밀러 사업 인수하면서 한국 위협
현재까지 미국에서 허가된 34개의 바이오시밀러를 오리지널 의약품별로 살펴보면 휴미라에 대한 바이오시밀러가 7개로 가장 많고, 다음으로 허셉틴 5개, 뉴라스타 및 레미케이드가 각각 4개, 뉴포젠 및 리툭산이 각각 3개 순으로, 이들 제품은 미국 시장에서의 치열한 경쟁이 예상된다.
34개 바이오시밀러를 허가받은 기업별로 살펴보면 가장 많이 허가받은 기업은 미국의 화이자로 총 7개의 바이오시밀러를 허가받았으며, 그 다음으로 한국의 삼성바이오에피스와 미국의 암젠이 각각 5개를, 미국의 마일란과 스위스의 산도스가 각각 4개, 한국 셀트리온 3개 순으로 허가를 많이 받았다.
한국은 미국에 이은 2번째 바이오시밀러 강국이지만, 최근 인도 기업이 미국의 바이오시밀러 강자인 비아트리스(마일란)의 바이오시밀러 사업을 인수한다고 발표하면서 미국 내 각 나라 간 바이오시밀러의 경쟁 기류에 변화가 있을 것이라는 예측이 나오고 있다. 인도 Biocon Biologics는 지난 2월 28일 마일란의 바이오시밀러 사업을 33억 달러에 인수하면서 기존 마일란이 미국에서 허가받은 4개의 바이오시밀러 보유 기업이 됐다.
세계 최대 매출 의약품인 휴미라에 대해서는 현재 7개의 바이오시밀러가 허가를 받아 출시준비 중이며, 출시 예정인 2023년부터 치열한 시장 경쟁이 예상된다.
미국에서 바이오시밀러는 오리지널 의약품에 비해 약가가 15%에서 35% 저렴하다. 미국은 OECD 32개국에 비해 전문의약품 약가는 256% 높고, 브랜드 의약품의 경우 344% 높으며, 미국 매출 상위 60개 품목은 395%, 바이오의약품은 295% 높은 것으로 알려졌다. 반면 제네릭의약품(바이오 제외)의 경우에는 OECD 32개국 약가의 84% 수준이다.
미국 바이든 행정부가 미국의 높은 전문의약품 약가와의 전쟁을 선포했으며, 미국 보건부(HHS)는 환자에게 저가의 옵션을 제공할 수 있는 제네릭 및 바이오시밀러 지원을 강화하기로 한 만큼 미국 바이오시밀러 시장은 더욱 확대될 것으로 보인다. 여기에 미국 FDA의 연이은 인터체인저블 바이오시밀러 지정으로 미국 바이오시밀러 시장의 확대는 가속할 것으로 전망된다.
업계 관계자는 “미국 바이오시밀러 시장의 확대는 국내 바이오시밀러 등의 미국 수출 확대에도 긍정적인 영향을 줄 것으로 예상한다”면서도 “바이오시밀러들의 공습에 오리지널 제약사들 역시 적극적인 특허 방어 전략으로 시장 진입을 견제하고 있고, 글로벌 바이오시밀러 시장의 경쟁이 치열해지는 만큼 우리 기업들도 차별된 전략으로 시장 경쟁에 대비해야 할 것”이라고 말했다.
[바이오타임즈=정민구 기자] news@biotimes.co.kr


