서울아산병원과 임상 협력…내년 상반기 중 임상 1상 첫 환자 투여 목표
[바이오타임즈] 앱클론(174900, 대표이사 이종서)이 개발 중인 신규 항체 적용 혁신 CAR-T 세포치료제 ‘AT101’에 대해 식품의약품안전처로부터 혈액암 환자 대상 국내 임상 1/2상 IND(임상시험계획)를 승인받았다고 밝혔다.
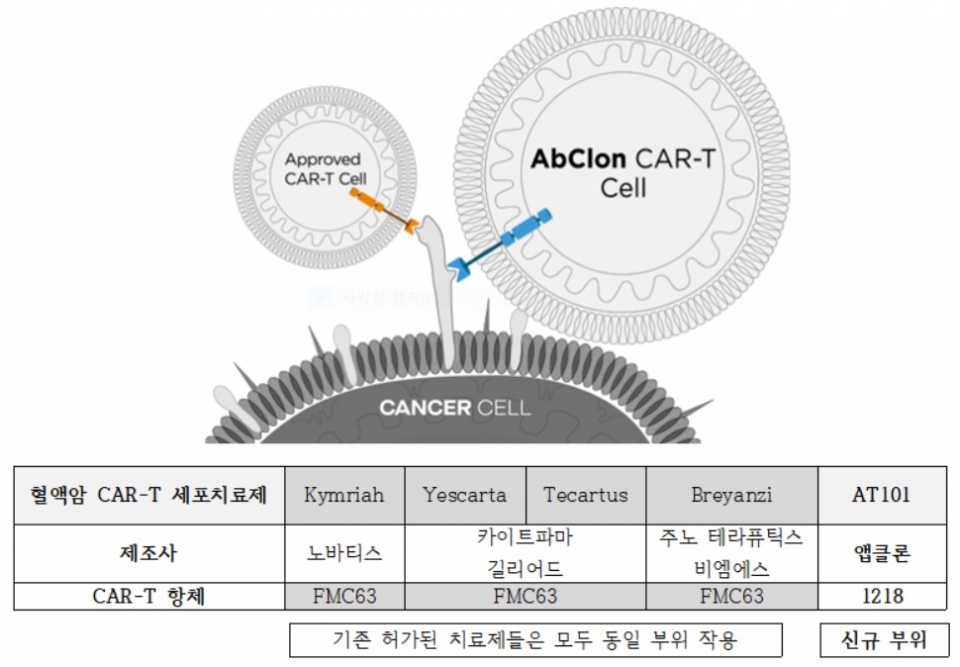
앱클론의 ‘AT101’은 질환 단백질 CD19을 표적하는 CAR-T 면역항암 세포치료제로, 기존의 혈액암 타깃 글로벌 블록버스터 CAR-T 세포치료제들과 적용 부위(에피토프)가 전혀 다른 것이 특징이다.
CAR-T 세포치료제는 기존의 항암제와는 달리 1회의 투여만으로도 혈액암의 완전관해(Complete response, CR)를 보이는 등 반응도와 치료 효과가 높아 ‘기적의 항암제’로 불리고 있다. 전 세계적으로 킴리아, 예스카타, 테카르투스 등 총 5종의 치료제가 승인됐으며, 국내에서는 현재 킴리아만 허가돼있다.
앱클론은 자체 항체 발굴 플랫폼 NEST(Novel Epitope Screening Technology)를 통해 새로운 에피토프에 최적화된 ‘1218 항체’를 개발하고 이를 AT101에 적용했다. 신규 에피토프를 타깃하면 기존 혈액암 환자뿐만 아니라 다른 CAR-T 치료제의 불응 환자 및 재발 환자들에게도 치료 효능을 보일 수 있어 향후 CAR-T 세포치료제 시장의 게임 체인저 역할도 기대된다.
이번 승인된 임상은 1상과 2상으로 구성되며, 약 100명의 임상 환자를 대상으로 AT101의 안전성, 내약성, 유효성을 평가할 예정이다. 임상 1상에서는 서울아산병원과 협력해 재발성 및 불응성 B세포 비호지킨 림프종(Non-Hodgkin’s Lymphoma, NHL) 환자를 모집하고, 안전성과 내약성을 분석해 임상 2상의 최대 내약용량과 권장 용량을 결정하게 된다. 이어 2상에서는 객관적 반응률(유효성)을 평가한다.
앱클론은 AT101의 전임상시험을 통해 킴리아 불응 및 재발 모델의 암세포 사멸 효과를 확인했으며, 이에 따라 본 임상에서도 유의미한 결과를 도출할 수 있을 것으로 기대하고 있다. 또한 AT101은 회사가 자체 개발한 1218 항체를 기반으로 개발돼 독자적 지적 재산권을 구축할 수 있으며, 더욱 향상된 치료 효능을 통해 글로벌 CAR-T 시장에서도 상업화에 높은 경쟁력을 가질 수 있을 것으로 전망된다.
앱클론은 임상 병원과의 신속한 협력을 토대로 내년 상반기 중 임상 1상 첫 환자 투여를 개시한다는 목표다.
앱클론 관계자는 “이번 임상을 바탕으로 AT101의 높은 효능을 입증하고 관계 기관과의 긴밀한 협의를 통해 국내 판매를 위한 조건부 허가를 신청할 계획”이라며 “혈액암으로 투병 중인 환자에게 더욱 저렴하고 효과적인 치료 기회를 제공할 수 있도록 임상 개발에 주력하겠다”라고 강조했다.
[바이오타임즈=최진주 기자] news@biotimes.co.kr


