
[바이오타임즈] 식품의약품안전처(처장 이의경, 이하 '식약처')가 의료제품 분야 올해 하반기에 실시되는 주요 정책을 소개했다. ▲의료기기 표준코드 부착 의무화(7월) ▲임상시험 정보 등록·공개 제도 시행(10월) ▲의료기기 규제과학(RA) 국가공인시험(11월) ▲의약품등 해외제조소 등록제(12월) 등이 시행될 예정이다.
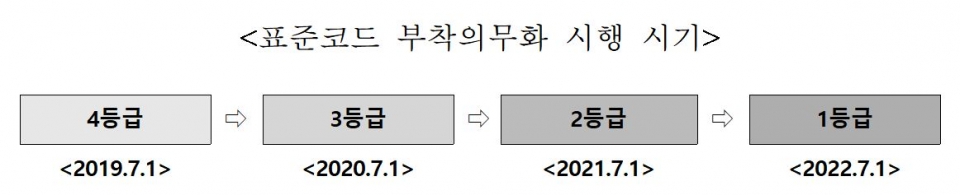
의료기기 표준코드 부착 의무화 본격 시행(‘19.7.1, 4등급)으로 허가부터 유통‧사용까지 각 단계별 정보를 통합 관리하는 전주기 통합 안전관리가 실시된다.
환자 맞춤형 임상시험 정보 제공으로 치료약이 없는 환자의 임상시험 참여를 지원하고 임상시험 수행과정의 안전성‧객관성‧투명성을 확보하기 위한 임상시험 정보 등록·공개 제도가 10월부터 시행된다.
10월 26일 이후 승인되는 임상시험은 '의약품통합정보시스템'에서 상세한 임상시험 승인 정보와 진행 현황 등이 확인 가능하며, 임상시험 정보 등록 방법 및 관련 용어에 대한 가이드라인을 마련할 예정이다.
기존 민간자격으로 운영하였던 의료기기 규제과학(RA) 전문가 2급 시험이 국가공인민간자격으로 승격되어 2019년 11월 16일 처음으로 시행된다.
의료기기 규제과학(RA) 전문가는 의료기기 개발부터 제품화 및 시판 후 관리 등에 필요한 ‘법적·과학적 규제기준’에 대한 전반적 지식을 갖춘 자이며, 응시원서는 10월1일부터 15일간 한국의료기기안전정보원 홈페이지를 통해 접수 할 수 있다.
마지막으로, 수입의약품에 대한 체계적인 관리체계를 구축하고 현지실사를 통해 위해발생 우려가 있는 경우 수입중단 등 실효성 있는 조치를 실시하기 위해 의약품을 생산하는 해외제조소의 명칭 및 소재지 등을 등록하는 해외제조소 등록제를 12월부터 시행한다.
[바이오타임즈=심선식 기자] macsim181@gmail.com


