전기자극 반응에 활성산소 발생, 내성 발생 없는 제균 실마리 될까?
[바이오타임즈] 인류의 생존을 위협하는 위험 가운데 하나로 꼽히는 ‘항생제 내성’은 코로나19 치료과정에서 급격히 증가할 수 있다고 보고(세계보건기구 WHO, 2020)되면서 심각성이 더욱 대두되고 있다.
항생제 내성은 항생제가 무력화되는 현상으로, 균이 어떠한 항생제의 사용에도 듣지 않게 된다. 주로 항생제에 노출된 세균 가운데 돌연변이를 통해 항생제의 표적이 되는 단백질을 변형시키면서 나타나는 것으로 알려져 있다.
특히 항생제 내성이 나타나면 여러 균에 의한 질병이 발생할 뿐 아니라, 병원에서 수술할 경우 발생하는 감염균에 의해 단순 찰과상까지 생명을 위협하는 질병으로 발전한다. 영국의회보고서(O'Neill Report)에 의하면 2050년에는 내성균에 의한 사망자가 연간 1,000만 명에 이르게 될 것으로 보고 있다.
전 세계 의학계에서는 항생제 내성을 극복할 수 있는 새로운 치료법을 다양하게 연구하고 있지만, 아직 실용화에는 이르지 못하고 있다.
이러한 상황에서 국내 연구진이 항생제 내성 박테리아에 대항하여 활성산소로 박테리아만 죽이는 나노로봇을 개발해 화제다.
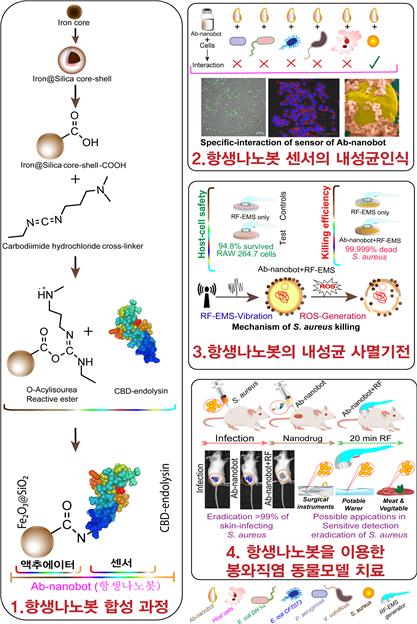
한국연구재단(이사장 노정혜)은 김경규 교수(성균관대 의학과) 연구팀(Chaurasia 박사, Batool 박사)이 이정헌(성균관대 신소재공학부), 유상렬(서울대학교 식품공학과) 연구팀과 함께 황색포도상구균에 선택적으로 결합, 외부 전기신호에 반응하여 활성산소를 발생 시켜 제균을 유도하는 20nm 크기의 나노로봇을 개발했다고 밝혔다.
연구팀은 이번 연구 결과가 내성 발생이 필연적으로 발생하는 기존 항생제의 제균(除菌) 방식과 다른 새로운 방식을 적용, 내성으로부터 자유로운 감염치료제 개발의 실마리가 될 것으로 보고 있다.
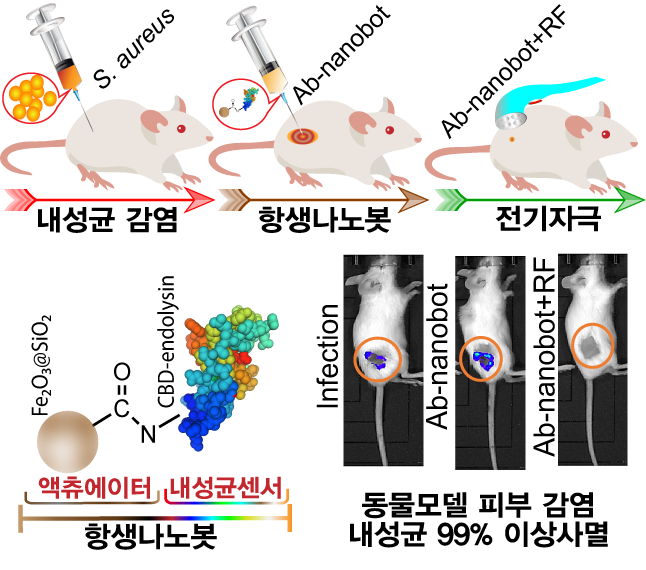
실제 연구팀이 피하조직에 내성 황색포도상구균이 감염된 봉와직염 생쥐모델에 나노로봇을 주입하고 전기신호를 가하자, 감염균이 빠르게 사멸되고 염증이 사라지는 것을 관찰했다.
연구팀은 동물 세포에 붙지 않고 세균에게만 달라붙어 원하는 때에 활성산소를 발생하는 나노로봇을 설계했다. 세균에 대한 선택성은 박테리오파지가 세균에 기생할 때 필요한 도킹 단백질(엔도라이신)을 철 나노입자에 코팅해 확보했다.
항생 나노봇의 활성을 확인하기 위해 황색포도상구균을 동물의 대식세포에 감염시킨 후, 나노봇을 처리하고 라디오 파장(Radio Frequency)을 갖는 교류전류를 가했다. 박테리아 표면에 붙은 나노봇은 전기자극에 반응하여 활성산소를 만들어 박테리아 세포막을 파괴시킴으로써 박테리아를 사멸시켰다. 이로써 항생 나노봇을 이용한 박테리아 피부감염 치료 가능성을 검증했다.
◇ 치료 불가능했던 내성균에 의한 감염 치료 대안되나
기존의 항생제는 세균이 가진 단백질을 표적하기 때문에 표적 단백질에 돌연변이를 갖는 세균이 적응과정에서 살아남아 필연적으로 내성균이 발생한다.
즉, 항생제 내성은 균이 항생 물질에 의하여 압박을 받을 때 돌연변이나 기타 유전자 차원에서 내성을 지닌 극소수의 개체가 살아남고, 세대를 거치면서 개체 수가 증폭, 결국 항생제 내성균으로 발전하는 자연적인 현상이다. 따라서 균을 죽이는 항생 물질은 필연적으로 내성을 유발한다.
반면 활성산소에 의한 세포막 손상은 단순한 유전자 돌연변이에 의해 극복될 수 없어 내성균이 발생할 가능성이 매우 낮다.
항생 나노로봇은 철나노 입자를 실리콘 및 단백질로 코팅하는 한편, 피부미용에 사용되는 낮은 에너지의 전기자극으로 나노로봇을 구동할 수 있도록 해 임상 적용 가능성이 높다는 설명이다.
동물모델에서의 이번 연구가 실용화되려면 생체적합 소재 및 구동 방법 최적화 등을 통한 안전성 입증 등이 필요하다.

김경규 교수는 “박테리아의 특정 단백질에 결합하여 이들의 활성을 화학적으로 저해하여 균을 죽이는 기존 항생제와는 달리, 항생 나노봇은 박테리아에 결합하여 외부 전기신호에 반응하여 세포를 사멸시키는 새로운 작용원리로 박테리아 감염을 치료하는 전략이라는 점에서 가장 큰 차이가 있다”고 말하며 “이러한 치료법은 내성의 원인과 무관하게 박테리아를 사멸시킬 수 있으므로 다양한 내성균에 의한 감염을 효과적으로 치료할 수 있으리라 생각하고, 기존의 항생제로는 치료가 불가능한 내성균에 의한 감염을 치료할 수 있는 대안이 될 수 있을 것”이라는 기대감을 나타냈다.
또한 연구팀은 “코로나 치료과정에서 폐 감염 치료를 위한 항생제 치료가 병행될 경우 새로운 내성 박테리아의 발생이 용이한 환경이 만들어지기 때문에 코로나 팬데믹에 의한 내성균 증가가 심각한 문제로 대두되고 있다”라고 말하며 “본 연구는 내성 세균을 제거할 수 있는 새로운 전략을 제안했다는 점과 항생제 내성 극복을 위한 중요한 전환점을 마련했다는 데 의의가 있다고 생각한다. 본 연구에서 증명한 원리를 실제 임상에서 적용할 수 있다면 내성균 감염 치료뿐 아니라, 내성이 발생하지 않게 박테리아 감염을 치료할 수 있으리라 기대된다”라고 밝혔다.
과학기술정보통신부와 한국연구재단이 추진하는 바이오‧의료기술개발사업의 지원으로 수행된 이번 연구의 성과는 나노의학 분야 국제학술지 스몰(Small)에 4월 10일(온라인) 게재되었다.
한편 김경규 교수(성균관대 의학과) 연구팀(Chaurasia 박사, Batool 박사)은 항생제 내성 치료제 연구소를 중심으로 항생제 내성을 극복하기 위한 다양한 연구를 수행 중이다. 2018년에는 미국 인디애나대학교 연구팀, 영국 사우스햄턴 연구팀과의 공동연구를 통해, 대표적인 내성균 중의 하나인 황색포도상구균을 직접 죽이지 않고 독성만을 저해하는 물질을 신선초에서 발굴하여 이 물질을 내성을 유발하지 않는 신개념의 항생제로 개발할 수 있다는 결과를 발표한 바 있다(Scientific Reports 2018, Journal of Medicinal Chemistry 2018). 연구팀은 이번 연구에서 또 다른 작용기전의 박테리아 감염 치료법을 제시하는 성과를 거뒀다.
[바이오타임즈=김수진 기자] sjkimcap@biotimes.co.kr


