재심사 제도와 중복되는 상황 없애려 위해성 관리계획으로 통합
[바이오타임즈] 식품의약품안전처(처장 이의경)는 의약품의 시판 후 안전관리를 위해 운영해온 ‘재심사’ 제도를 전(全) 주기 안전관리 체계인 ’위해성관리계획(RMP)‘으로 통합 운영하는 것을 주요 내용으로 하는 「의약품 시판 후 안전관리 제도 개선 방안」을 마련했다고 밝혔다.
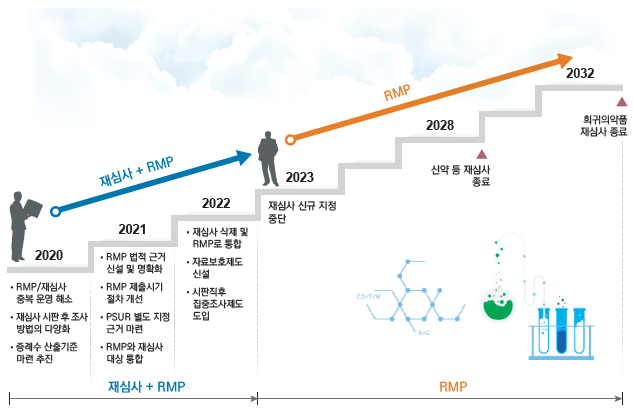
식약처의 ‘재심사’(1995년~)와 ‘위해성관리계획’(2015년~)는 의약품의 시판 후 안전사용을 위해 도입된 제도이다.
식약처에 따르면 ’19년 기준 위해성관리계획 의약품은 전년 대비 275품목(195%), 재심사 의약품은 196품목(134%) 증가하는 등, 위해성 관리계획 품목의 77.5%가 재심사 대상으로도 지정되는 등 자료의 중복제출에 대한 개선과 체계적 관리 필요성이 제기되어 왔다.
이에 따라, 식약처는 의약품 시판 후 안전관리 제도를 일원화하고 국제조화를 이루기 위해 단계적으로 개선을 추진한다.
1단계로 2020년까지 위해성 관리계획, 재심사의 중복된 부분을 해소하고 2단계로 2021년까지 위해성 관리계획의 효율성을 강화한다.
마지막 3단계로 2022년까지 이원화되어 있는 재심사와 위해성 관리계획을 위해성관리계획으로 일원화한다.
이에 따라 2022년부터는 재심사 신규 지정을 중단하여 2032년까지 희귀 의약품 재심사를 종료하는 것을 목표로 한다.
아울러, 신약, 자료제출의약품 등 안전정보가 제한적인 의약품에 대해 시판 직후 일정 기간 의약품 사용 정보를 적극적으로 수집하도록 추가적인 약물감시 제도(가칭 : 시판직후집중모니터링)를 도입할 예정이다.
식약처의 이의경 처장은 “의약품 시판 후 안전관리는 허가 당시에는 예상할 수 없었던 의약품의 부작용을 모니터링하고 이를 통해 안전한 의약품 사용을 도움으로써 그 중요성이 높아지고 있어, 식약처도 이번 단계적 개선을 통해 제도를 효율화하여 정부와 업계의 역량을 집중함으로써 시판 후 안전관리를 강화해 나가겠다”라고 밝혔다.


