한국, 해외사례 통해 연계제도 검토 필요
유럽 수출제조면제, “2만 5,000개 일차리 창출 기대”
[바이오타임즈] 다른 산업과 마찬가지로 제약∙바이오 산업에서도 제품의 상용화를 위해 특허권을 확보하는 것이 매우 중요하다. 그래야만 제품 출시를 위한 준비나 신약기술 이전 등에 나설 수 있다. 그러나 의약품의 실제 사업을 위해서는 임상실험이나 허가절차 등을 거쳐야만 한다.
일례로 특허권은 보통 출원일로부터 20년 동안 특허권자에게 유지되는데 만약 특허를 가진 제약회사가 임상시험과 허가절차에만 약 15년이 넘게 걸렸다면 실질적으로 특허권을 행사하는 기간은 불과 5년뿐이다. 특히 임상실험은 최소 5년이 걸리고 여기에 많은 비용과 인원이 소요된다. 기업이나 연구소는 병원의 의사나 임상환자 등의 허락을 구해야 하는 것도 시간이 걸리는 이유다. 특허법인 테헤란 백상희 대표변리사는 “특허권을 보다 길게 행사하기 위해 특허등록을 빠르게 받고 임상시험과 허가기간을 단축시키는 전략이 필요하다”고 말했다. 한국은 한-미 FTA 협정에 따라 2015년 3월 ‘의약품 허가-특허 연계제도’(이하 연계제도)를 도입해 특허권 보호를 강화하고 있다.

특허권 보호와 후발주자 진입억제 효과 목적
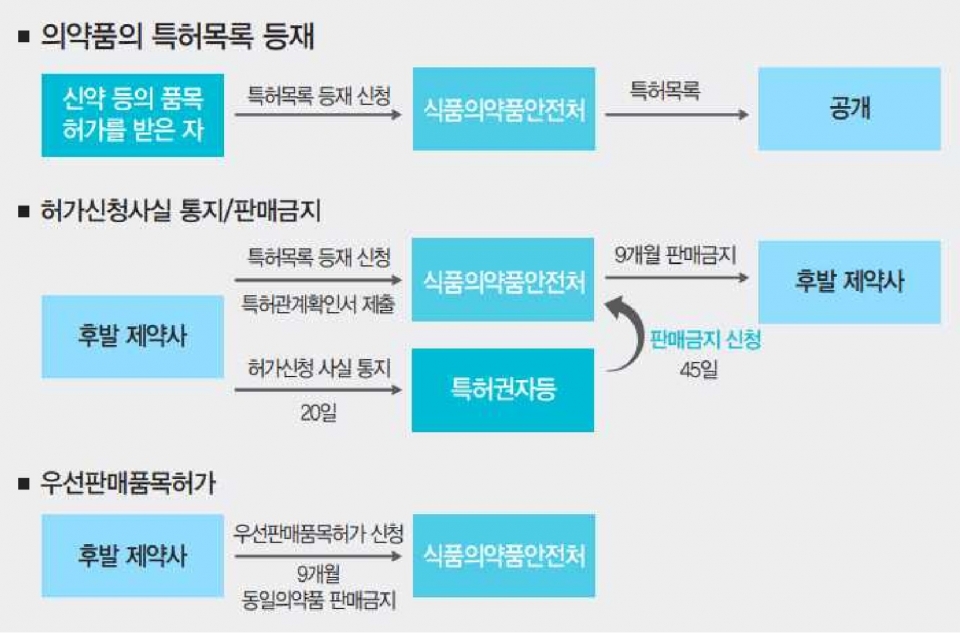
연계제도는 특허기간 동안 허가와 특허를 연계해 복제의약품의 시판을 금지하는 것이다. 만약 복제의약품 제조기업이 식품의약품안전처에 약품을 등록하면 오리지널 제약사는 최장 9개월간 판매를 중지시킬 수 있는 ‘판매금지권리’가 부여된다. 반면 복제의약품 제조기업이 특허소송에서 승소하면 9개월의 ‘우선판매권리’를 갖는다. 이는 의약품 허가 심사과정에서 품목허가 전 특허 침해여부를 검토해 특허권 보호를 강화하면서도 후발주자 간 경쟁을 완화시키는 것이 목적이다.
연계제도는 ▲의약품의 특허목록등재 ▲품목허가신청사실의 통지 ▲판매금지 ▲우선판매품목허가 등 4가지 절차로 구성된다. 특히 판매금지 조치는 이 제도의 핵심으로 오리지널 제약사의 특허권 보호를 강화하고 후발 의약품의 시장진입을 억제할 수 있다는 점에서 가장 많은 논란이 야기됐다.
그러나 한국지식재산연구원이 2018년 9월 발행한 ‘바이오시밀러와 의약품 특허 보호’에 따르면 이 제도는 초기 예상했던 것 보다 시장진입 억제에 대한 영향이 미미했던 것으로 분석된다. 연구원이 제도가 시행된 후 2017년 3월까지의 판매금지조치 현황을 살펴본 결과 특허권을 보유한 국내 6개, 외국계 11개 등 총 17개 오리지널 제약회사는 75개(19개 성분) 통지의약품에 대해 판매금지를 신청했지만 이중 26개(5개 성분)만이 판매금지 조치가 내려졌다. 또 실제 판매금지 기간은 평균 2개월로 최대 판매금지 기간인 9개월 보다 현저히 짧았던 것으로 나타났다.
미래전략연구실 김아름 연구원은 “오리지널 제약회사 입장에서 시간적∙금전적 비용을 고려했을 때 판매금지 신청의 실익이 적었다”면서도 “아직 이 제도가 시행 초기라는 점을 볼 때 향후 중∙장기적 연구로 검토∙분석할 필요가 있다”고 말했다. 이어 “한국은 내수시장 규모가 작아 제약산업에서는 수출 중심의 수익구조를 구축하는 것이 장기적 관점에서 유리하다”며 “미국과 유럽 등 해외사례를 통해 연계제도를 다시 한 번 검토해볼 필요는 있다”고 강조했다.
미국, 해치-왁스만법 개정 후 복제의약품이 가격 경쟁력 갖춰
그렇다면 미국과 유럽에서는 연계제도가 어떻게 제정됐을까. 미국에서는 지난 1984년 해치-왁스만법(Hatch-Waxman Act)을 제정하면서 연계제도가 최초로 도입됐다. 특허권자에게는 판매금지신청으로 특허권 보호를, 복제의약품 허가신청인에게는 약식허가 등으로 보상을 제시했다. 해치-왁스만법의 입법 목적은 복제의약품의 시장진입을 수월하게 하는 것이었다. 이를 통해 복제의약품 제약회사는 임상시험을 반복하지 않고 ‘간편화된 신약신청 절차’(Abbreviated New Drug Application, ANDA)를 제출해 승인신청을 손쉽게 할 수 있게 됐다.
2003년 12월 미국은 해치-왁스만법을 개정해 복제의약품 허가과정에서 문제가 됐던 부분을 보완했다. 개정된 법의 주요 내용은 ▲오렌지북(orange book, 승인의약품목록) 등재 특허범위 명확화 ▲특허 소송 시 30개월 연장 1회만 허용 ▲퍼스트 제네릭(first generic, 가장 먼저 만들어진 복제의약품) 180일 독점기간 구체적 조항 명시 등이다. 이와 함께 미국 내 복제의약품은 가격경쟁력을 갖출 수 있었다.
유럽 SPC, 유럽 기업의 내수시장 선점 기회 상실시키기도
유럽은 제약산업의 혁신투자를 보상하고 지식재산권을 보호하기 위해 지난 1992년부터 추가보호증명제도(Supplementary Protection Certificate, SPC)를 도입했다. 유럽의 특허권 존속기간도 한국과 마찬가지로 20년이다. SPC는 특허권 만료 후 의약품 허가 등을 이유로 개발을 진행할 수 없었던 기간에 대해 추가적인 보호권을 최대 5년까지 부여하는 것이다. SPC로 보호받을 수 있는 대상은 사람 또는 동물용 의약품(medicinal product)과 식품보호제품(plant protection product)으로 제한했다.
그러나 SPC 기간 동안에는 기간이 만료됐거나 존재하지 않는 해외시장으로의 수출 등 어떤 목적으로도 유럽 내에서는 복제의약품 제조가 불가했다. 이런 이유로 복제의약품이 제때에 시강에 진입하지 못하는 결과가 발생하기도 했다. SPC 제도권 밖의 해외 복제의약품 기업은 만료일 이후 즉시 유럽 시장에 해당 제품을 판매할 수 있었지만 유럽 내 기업은 만료일 이후부터 제조공정에 들어가야 했다. 결과적으로 유럽 제약회사가 유럽시장을 선점할 수 있는 기회가 상실됐다.
유럽연합집행위원회(European Commission, EC)가 2015년 SPC를 개정하면서 유럽에는 수출제조면제가 도입됐다. 이로써 SPC 기간에도 유럽 내 제약회사의 복제의약품 제조가 가능해졌다. 이들이 직면하고 있는 경쟁적 불리함도 제거할 수 있었다. EC는 2018년 경제적 영향평가를 통해 “수출제도면제 도입 후 10년 간은 매해 10억 유로(한화 약 1조 3,2016억 원) 이상의 순수출액이 발생할 것”이라며 “약 2만 ~ 2만 5,000개 의 일자리 창출도 기대해볼 수 있을 것”이라고 말했다.
[바이오타임즈=염현주 기자] yhj@biotimes.co.kr


