
암젠과 엘러간이 유방암 치료제 허셉틴(트라스트주맙)의 바이오시밀러 칸진티(트라스투주맙-anns)에 대한 미국 식품의약국(FDA) 승인을 획득했다. 이달 중 미국 특허 만료를 앞둔 허셉틴은 현지 시장에서 바이오시밀러 간 경쟁이 뜨거워 질 것으로 보인다. 앞서 셀트리온과 삼성바이오에피스도 허셉틴의 바이오시밀러 품목허가를 받아 놓은 상태다.
미국의 생명공학기업 암젠은 지난 13일(현지시간) 자사의 홈페이지에서 FDA가 자사의 바이오시밀러 칸잔티에 대한 품목허가를 승인했다고 발표했다. 허셉틴은 상피세포 성장인자2(HER2) 과발현 전이성 유방암 및 HER2 과발현 위암 그리고 위식도 접합부 선암을 적응증으로 하는 블록버스터 생물의약품이다. FDA는 기존 제품인 허셉틴에 대해 승인된 모든 적응증을 대상으로 승인했다.
트라스트주맙은 DNA에서 추출한 단세포 면역 글로불린 G1 카파 항체다. 칸진티의 활성 성분은 트라스트주맙과 동일한 아미노산 서열, 구조 및 기능을 갖는 인간화 단일 클론 항체이다.
지난 2011년 12월, 암젠과 엘러간(당시 왓슨 파마수티컬스)는 4개의 항암-항체 바이오시밀러 의약품의 개발 및 상용화를 위한 협업을 맺었다. 협약 조건에 따라 암젠은 제품의 개발, 제조, 초기 상용화에 대한 1차 책임을 맡고 있다.
앨러간의 수석 연구 개발 책임자 데이비드 니콜슨(David Nicholson)은 “칸진티는 암젠과 알러겐이 공동개발중인 4가지 바이오시밀러 중 2번째로 FDA의 승인을 받은 제품” 이라고 밝혔다.
데이비드 리스(David Reese) 암젠의 연구개발 부문 부사장은 "칸진티의 FDA 승인은 바이오시밀러 포트폴리오에 3종류의 암환자들에 대한 치료 옵션을 추가할 수 있었던 중요한 성과"라고 말했다. 그는 또한 “칸진티는 우리의 포트폴리오에서 FDA의 허가를 취득한 3번째 바이오시밀러다. 중증질환 환자들에게 품질높은 생물의약품의 접근이 가능하도록 오랜 기간 노력을 기울여 왔다”고 덧붙였다.
암젠에 따르면, 칸진티는 광범위한 비교 분석, 약동학 및 임상 데이터를 포함하는 포괄적인 증거를 기반으로 대조약인 허셉틴과 매우 유사하며, 임상적으로 유의미한 차이가 없음을 보여주었다. 칸진티는 임상시험에서 단일제로의 평가시 허셉틴을 사용하던 환자들과의 안전성 및 면역원성이 입증된 유일한 트라스투주맙 바이오시밀러이다.
암젠은 자사의 포트폴리오에 10개의 바이오시밀러를 보유하고 있다. 이 중 3개는 미국에서 허가를 취득했으며, 3개는 EU에서 발매를 승인받았다.
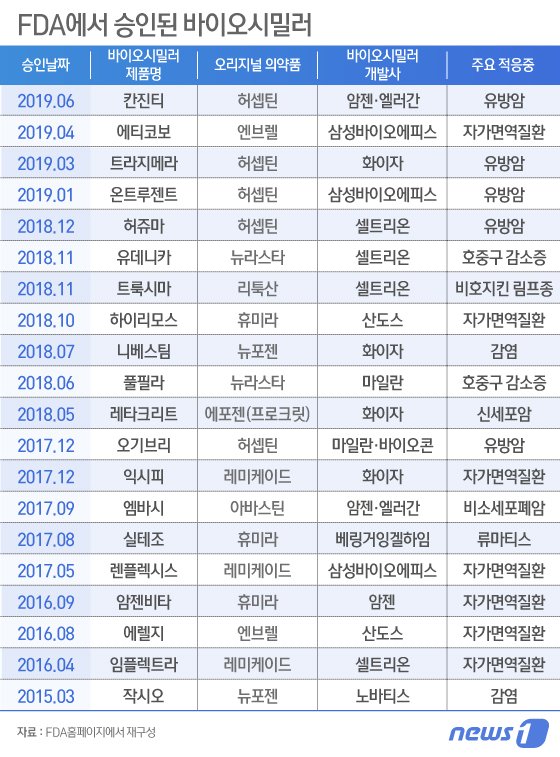
현재 FDA에서 승인된 바이오시밀러는 총 20개로 알려졌다. 그중 FDA의 허셉틴 바이오시밀러 품목허가는 마일란·바이오콘의 오기브리(MYL-1401O), 셀트리온의 CT-P6(유럽명:허쥬마), 삼성바이오에피스의 SB3(유럽명:온트루잔트) 그리고 화이자의 트라지메라(Trazimera)에 이어 다섯 번째다.
이번달 허셉틴의 미국 특허가 만료됨에 따라 허셉틴은 유럽과 일본에 이어 미국시장에서도 바이오시밀러와의 경쟁으로 인한 매출 하락이 점쳐지고 있다.
허셉틴은 2017년 한 해에만 처방 매출 74억4100만달러를 기록하면서 전세계 바이오의약품 매출 3위를 기록했다. 유럽에서는 지난 2014년 특허가 만료되어 이미 바이오시밀러와 경쟁을 하고 있으나 미국시장에서는 올 6월 특허가 만료된다.
허셉틴의 특허 만료를 계기로 바이오시밀러의 경쟁이 치열해지고 있다. 이번에 허가받은 바이오시밀러외에 현재 개발중인 허셉틴의 바이오시밀러는 총 10개가 넘는 것으로 알려졌다.
바이오시밀러가 시장 점유를 위해 미국 시장 판매허가를 받았더라도 바로 시장에 진입할 수 있는것은 아니다. 오리지널 제약사가 걸어놓은 특허소송 등 각종 장애물이 남아있다.
미국시장에서 허셉틴의 바이오시밀러를 허가받은 셀트리온은 지난 1월 허셉틴의 오리지널 판매사인 로슈와의 특허관련 협의가 마무리된 상태이다. 그동안 셀트리온은 허셉틴의 원개발사인 제넨텍과 소송을 진행 중이었다. 한편 삼성바이오에피스는 자사의 바이오시밀러 SB3에 대한 특허분쟁이 아직 완료되지 않은 것으로 알려졌다.
<기사출처_뉴스1>


